飼料中添加植物乳桿菌對細鱗鮭生長及腸道菌群多樣性的影響
摘要:本試驗旨在研究飼料中添加植物乳桿菌(Lactobacillus plantarum)對細鱗鮭生長及腸道菌群多樣性的影響。以基礎飼料為對照組,在基礎飼料中添加1×106 CFU/g植物乳桿菌為試驗組,每組3個重復,每個重復25尾平均體重5 ~ 8 g的細鱗鮭,在室內養殖56 d后,取中后腸段內容物及其黏膜,提取微生物DNA,采用高通量測序技術檢測腸道菌群多樣性。結果顯示:與對照組相比,飼料中添加植物乳桿菌可顯著增加細鱗鮭的特定生長率(P<0.05)。α多樣性分析顯示試驗組腸道菌群多樣性(Shannon指數、Simpson指數)和豐富度(Ace指數、Chao 指數)均較對照組顯著降低(P<0.05)。β多樣性分析發現試驗組和對照組腸道菌群分群明顯。在門水平上,試驗組腸道菌群中厚壁菌門(Firmicutes)的豐度達96.03%,而對照組主要由幾個豐度較大的菌門組成,分別為厚壁菌門(23. 79%)、藍細菌門(Cyanobacteria)(23. 30%)、擬桿菌門(Bacte⁃roidetes)(8.95%)、螺旋菌門(Spirochaetae)(6.67%)和放線菌門(Actinobacteria)(5.35%)。在屬水平上,試驗組腸道菌群中豐度大于1% 的菌屬僅有3個,為乳桿菌屬(Lactobacillus)(58.94%)、微小桿菌屬(Exiguobacterium)(26.00%)和腸球菌屬(Enterococcus)(10.62%),總豐度達95.66%,而對照組豐度大于1%的菌屬達11個,但總豐度僅為58.24%,主要有未命名_藍細菌門(unclassified_Cyanobacteria)(23.30%)、勞爾氏菌屬(Ralstonia)(11. 70%)、短螺旋體屬(Brevinema)(6.67%)和普氏菌屬(Prevotella)(3.90%)。綜上,飼料中添加植物乳桿菌能促進細鱗鮭的生長,提高其腸道中乳酸菌的比例,抑制其他菌群的生長,降低腸道菌群的多樣性。
動物腸道內存在著一個數量巨大的菌群生態系統,這些菌群與其宿主動物相互作用,對動物生理功能產生了重要影響。多數情況下,這種影響是有益的,能夠增強動物免疫力、促進營養吸收,在抑制外來有害菌群、保護動物腸道健康方面也起到了重要作用。因此,益生菌對動物生理功能及腸道菌群的改善引起了人們的關注。目前對水生生物腸道菌群的研究集中于2個方面:一是對魚類腸道菌群組成的研究。例如,黃麗麗等用16S rRNA基因高通量測序的方法研究了新疆額爾齊斯河流域的多種冷水魚類,包括狗魚(Esox reicherti)、哲羅魚(Hucho taimen)、細鱗鮭的腸道微生物菌群結構,在門和屬的水平上揭示了魚類腸道菌群的組成。Wu等研究發現草魚(Ctenopharyngodon idellus)腸道內含有大量纖維素降解菌,其中變形菌門(Proteobacteria)、厚壁菌門(Firmicutes)、放線菌門(Actinobacteria)是草魚腸道的核心菌群。二是對魚類腸道菌群調控的研究,目的是通過調控腸道菌群來改善動物的免疫、生長、營養等狀態。例如,Nikoskelainen等使用鼠李糖乳桿菌(Lactobacillus rhamnosus)調控虹鱒(Oncorhynchus mykiss)腸道菌群組成,增加了乳桿菌、雙歧桿菌(Bifidobacterium)等有益菌的數量,并抑制了有害菌的增殖。尹軍霞等給鯽魚(Carassius auratus)飼喂添加乳酸桿菌的飼料,通過培養基分離培養的方法發現益生菌投喂增加了鯽魚腸道雙歧桿菌及乳酸桿菌的數量。在營養調控方面,Bogut等發現益生菌復合制劑能夠改善鯉魚(Cyprinus carpio)的生長速度和飼料轉化率。Hoseinifar等發現嗜酸乳桿菌(Lactobacillus acidophilus)能提高養殖10周的劍尾魚(Xiphophorus helleri)皮膚黏膜免疫功能,還能提高其增重率及特定生長率,降低飼料轉化率。Gioacchini等使用鼠李糖乳桿菌飼喂斑馬魚(Danio rerio),發現益生菌促進了斑馬魚的排卵數量及破膜率,卵母細胞成熟相關基因的表達上調。
細鱗鮭(Brachymystax lenok)是一種常年生活在低溫水環境下的冷水魚類,其生活水溫通常不超過18℃。因此,在低溫條件下,益生菌能否影響腸道菌群并發揮其功能,有待探索驗證。植物乳桿菌(Lactobacillus plantarum)是飼料及食品中常用的益生菌,可分泌乳酸,抑制有害菌,幫助分解膽固醇及脂類,提高動物免疫力和健康水平。本文擬就植物乳桿菌在冷水魚細鱗鮭腸道菌群調控中的作用進行研究,為冷水魚中益生菌的研究及應用提供參考。
1.材料與方法
(1)試驗設計
飼養試驗在內蒙古民族大學冷水魚養殖實驗室內進行,具有水溫調控系統和過濾系統。細鱗鮭魚苗購自丹東鳳城冷水魚養殖基地,魚苗體長6 ~ 7 cm,體重5 ~ 8 g,先預養殖20 d。將試驗魚于6個養殖桶內養殖,養殖桶高1.5 m,直徑1.5 m,底部直徑1.2 m,每桶投放25尾。將6個養殖桶編號,A1、A2、A3分至對照組,B1、B2、B3分至試驗組,對照組投喂基礎飼料,試驗組投喂添加植物乳桿菌(購自中國科學院微生物研究所)飼料,每日投喂2次,日投喂量占魚體重的10% ~ 15%(根據魚類攝食情況調節投喂量),每日使用吸底器吸除底部殘留的魚餌和糞便。試驗期間,2 ~ 3 d換水1次,換水量為總水量的40% ~ 60%;養殖水溫控制在12 ~ 15℃ ,溶氧水平控制在6 mg/mL以上,pH為6.7±0.4,循環水流動從養殖桶頂部流下。養殖起始時間為2017年11月15日,結束時間為2018年1月10日,試驗期56 d。
(2)飼料制備
飼養試驗使用自制的全價配合顆粒飼料,粒徑2 ~ 3 mm,基礎飼料組成及營養水平見表1。試驗組飼料是在基礎飼料上噴植物乳桿菌菌液,使每克飼料中植物乳桿菌活菌數量達到1×106 CFU。
(3) 樣本采集與處理
在養殖28和56 d時各采樣1次,其中28 d時僅測定體長、體重,并每桶取3條魚解剖取肝臟稱重。取樣前停食24 h,先對各桶魚進行計數,稱重,測量體長,計算特定生長率。每桶取3尾規格基本一致的魚,先用MS⁃222麻醉,然后用70%酒精擦拭魚體表面,在超凈臺內無菌操作,解剖、分離并取出肝臟,對肝臟稱重,分離并取出中后腸段的內容物,然后用滅菌解剖刀刮取腸道內側黏膜,與內容物混合后,液氮速凍,-80℃保存。
(4)生長指標的計算
增重率(%)=[(終末體重–初始體重)/初始體重] ×100
特定生長率(%/d)= [(ln終末體重–ln初始體重)/養殖天數] ×100
肝體指數(%)=(肝體重/體重)×100
(5) 腸道菌群多樣性的測定
取約0.5 g腸道內容物與黏膜混合樣品,按照使用MP⁃bio土壤DNA提取試劑盒說明提取細菌基因組,將提取的DNA進行1.5%瓊脂糖凝膠電泳,并用Nanodrop對DNA的濃度和OD260 nm/OD280 nm值進行測定。
首先針對16S rRNA基因的V3 ~ V4區設計引物,引物兩端帶有12 bp的barcode,用以識別不同樣品的序列。然后進行PCR擴增,程序如下:95 ℃預變性3 min,之后進入擴增循環,循環數27,循環過程為95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸45 s,最后是72 ℃延伸10 min。擴增產物使用2%濃度的瓊脂糖凝膠進行電泳檢測;使用Thermo Scientific公司的GeneJET膠回收試劑盒回收產物;使用Illumina測序專用的NEB NextUltraTM DNA Library Prep Kit試劑盒按照說明建立基因克隆文庫。構建好的文庫經過Qubit定量和檢測合格后,基于Illumina Miseq PE300平臺進行高通量測序(上海美吉生物工程有限責任公司)。
使用Usearch (version 7.0)軟件( http://drive5.com/uparse/),將所得序列根據97%相似度關系進行操作分類單元(OTU)聚類分析,產生OTU表,并與Silva數據庫(http://www.arb⁃silva.de)比對進行分類學分析,所用平臺為Qiime平臺(http://qiime.org/scripts/assign_taxonomy. html),統計后得到各樣本的群落組成。然后對群落進行基于OTU水平的α多樣性分析,所用軟件為Mothur(version v.1.30.1,http://www.mothur.org/wiki/Schloss_SOP#Alpha_diversity),分析指標包括Sobs指數、Shannon指數、Chao指數、Simpson指數、Ace指數以及覆蓋度(coverage)。腸道菌群組成分析及熱圖使用R語言工具作圖,主成分分析(PCA)采用R語言的vegan軟件包進行分析和作圖。
(6)數據統計與分析
試驗數據經Excel 2007軟件初步整理后,使用SPSS 19.0軟件進行單因素方差分析(one⁃wayANOVA),采用Tukey法進行平均值間的多重比較,P<0.05為差異顯著,描述性統計值以平均值±標準差(mean±SD)表示。
2. 結果與分析
(1)植物乳桿菌對細鱗鮭生長的影響
由表2可知,經過56 d的養殖,對照組試驗魚體重為(18.23±0.45) g/尾,試驗組試驗魚體重為(19.08±0.14) g/尾,組間差異顯著(P <0.05);試驗組的增重率在養殖28及56 d時均顯著高于對照組(P<0.05)。試驗組的特定生長率在養殖28及56 d時均顯著高于對照組(P
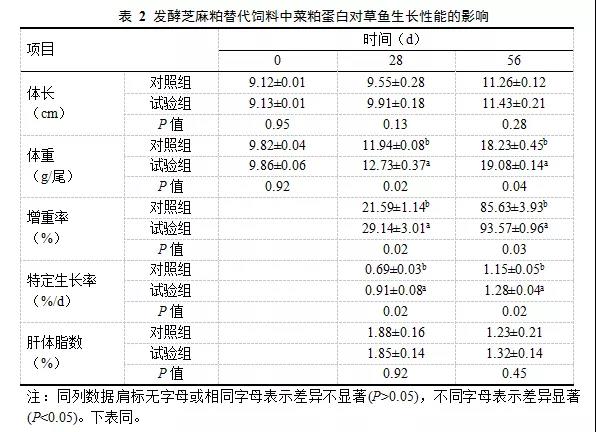
(2) 基于16S rRNA 基因測序的α多樣性
獲得原始序列數1228410條,經過質量控制,包括去除質量值低于20的尾部堿基及含氮的堿基,根據雙端序列間的重疊關系進行序列拼接,通過末端條形碼識別得到每個樣本的序列,最終得到優化序列數312339條,平均序列長度為444.85bp。其中對照組獲得的有效序列數為43165條,試驗組獲得的有效序列數為58910條,2組之間差異顯著(P<0.05)(表3)。在后續分析中,為降低統計誤差,將每個樣本序列數抽平至37818條。
各組的覆蓋度均約等于1.00,說明了該測序結果已基本覆蓋樣本的多樣性。基于97%相似性水平劃分得到810個OTU,它們分別歸屬644個種、454個屬、213科、113目、53綱、26門。α多樣性指數包括Sobs指數、Shannon指數、Simpson指數、Ace指數、Chao指數,對對照組和試驗組α多樣性指數的平均值進行顯著性分析,結果顯示2組之間上述指標均存在著顯著差異(P < 0.05)(表3)。此外,Sobs指數由對照組的439降低到試驗組的196,組間差異顯著(P<0.05)(表3),表明植物乳桿菌的添加顯著降低了樣本中所觀察到的物種數目;Shannon指數由對照組的4.0183降低到了試驗組的1. 3275,Simpson指數由對照組的0.0986升高到了試驗組的0.4029,表明對照組細鱗鮭腸道菌群多樣性較試驗組腸道高,植物乳桿菌的添加顯著降低了細鱗鮭腸道菌群多樣性;Chao指數由對照組的446.2992降低到了試驗組的249.3476,Ace指數由對照組的443.7244降低到了試驗組的251.1307,表明對照組細鱗鮭腸道菌群物種豐富度較試驗組高,植物乳桿菌的添加顯著降低了細鱗鮭腸道菌群物種豐富度。稀釋曲線(圖1)顯示,各樣本曲線均已進入平臺期,表明測序深度可靠,能夠真實反映樣本中大多數微生物組成情況。

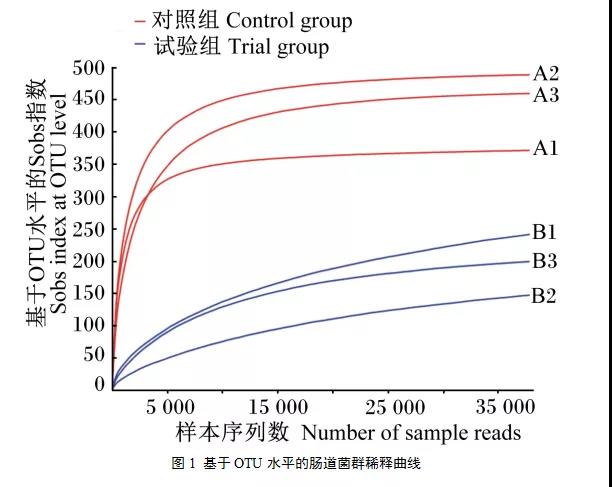
(3) 植物乳桿菌對細鱗鮭腸道菌群組成的影響
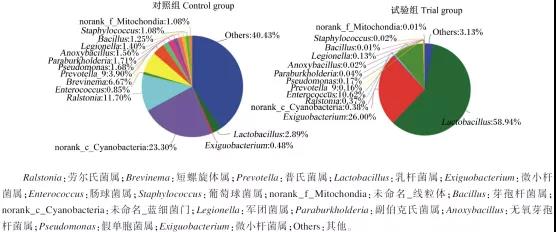
在門水平上,試驗組腸道菌群中,厚壁菌門的豐度達96.03%,占絕對優勢,變形菌門的豐度為2.54%,其他門類的豐度均低于1%。對照組腸道菌群中,厚壁菌門的豐度為23.79%,相比試驗組差異顯著(P< 0.05),藍細菌門(Cyanobacteria)的豐度為23.30%,擬桿菌門(Bacteroidetes)的豐度為8.95%,螺旋菌門(Spirochaetae)的豐度為6.67%,放線菌門(Actinobacteria)的豐度為5.35%,豐度低于1%的物種的總豐度很高,達到41.28%。
在屬水平上,對照組和試驗組腸道菌群組成差別也很大。對照組中豐度在1%以上的屬有11個,豐度低于1%的屬的總豐度達41.76%,其中豐度相對較高的菌屬有未命名_藍細菌門(norank_c_Cyanobacteria)(23.30%)、勞爾氏菌屬(Ralstonia)(11.70%)、短螺旋體屬(Brevinema) (6.67%)、普氏菌屬(Prevotella)(3.90%)和乳桿菌屬(Lactobacillus)(2.89%)。而試驗組中豐度高于1%的菌屬僅有3個,以乳桿菌屬的豐度最高,占58.94%,微小桿菌屬(Exiguobacterium)占26.00%,腸球菌屬(Enterococcus)占10.62%,其他豐度低于1%的菌屬的總豐度僅占4.44%。
(4) 植物乳桿菌對細鱗鮭腸道菌群β多樣性的影響
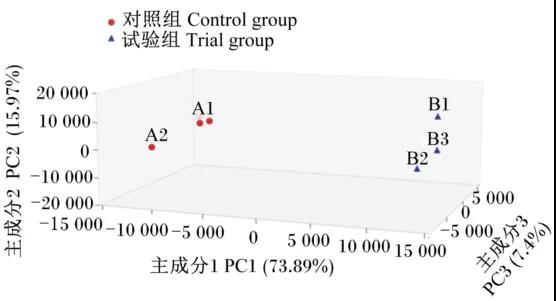
三維PCA圖(圖4)顯示,來自試驗組和對照組的腸道菌群樣本分別聚類成2 個群體,這種聚類主要體現在主成分1(PC1)上,PC1坐標軸的影響因素占總成分的73.89%。Venn圖(圖5)分析顯示,在所有樣本的1107個OTU中,共有OTU數為359個,占OTU總數的32.40%;對照組特有OTU數達到了418個,占OTU總數的37.80%;而試驗組特的OTU數為34個,僅占OTU總數的3.10%。試驗組OTU數(393個)遠少于對照組(777個),使得物種豐富度降低約49.42%。
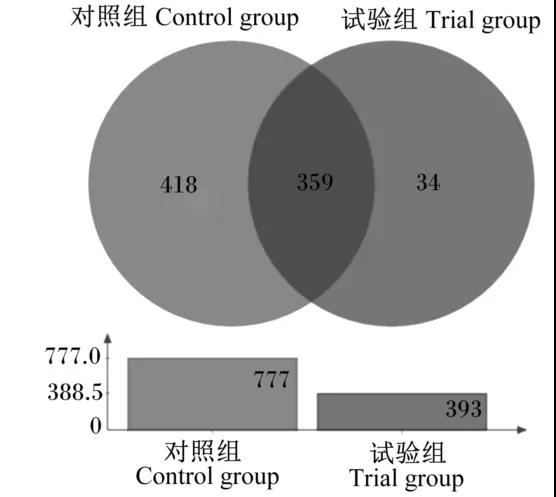
為反映細鱗鮭腸道菌群與植物乳桿菌處理的關系,進行了熱圖構建分析(圖6),圖中不同的顏色代表了不同菌群的豐度,左側代表基于屬水平的菌群系統發育進化樹,圖中頂端代表樣品聚類關系。熱圖顯示,對照組的3個樣本彼此臨近,而試驗組的3個樣本彼此臨近,2組樣本各自聚類成1個群體,結合菌群的進化關系,說明2組細鱗鮭腸道菌群組成差別明顯。從熱圖還可以看出,添加植物乳桿菌導致許多菌屬受到抑制甚至從腸道菌群中消失,如葡萄球菌屬(Staphylococcus)、桿菌屬(Geobacillus)、梭菌科-1屬(Clostridiaceae_1)、芽孢桿菌屬(Bacillus)、無氧芽孢桿菌屬(Anoxybacillus)、芽孢八疊球菌屬(Sporosarcina)、副伯克氏菌屬(Paraburkholderia)、鏈球菌屬(Streptococcus)、類諾卡氏菌屬(Nocardioides)、氣單胞菌屬(Aeromonas)、普氏菌屬等。此外,相比對照組,試驗組中腸球菌屬、乳桿菌屬、微小桿菌屬這3個菌屬的豐度增加明顯。與之對應的是,Venn圖顯示多達284個OTU從試驗組中消失(圖5),說明添加的植物乳桿菌在細鱗鮭腸道內抑制了多種菌群的生長,改變了其菌群組成。

3. 討論
健康的腸道菌群結構對動物多種生理機能有重要的影響,如營養吸收、生長發育、免疫調節、疾病預防等。本研究發現,雖然添加植物乳桿菌未對細鱗鮭的體長產生顯著影響,但對細鱗鮭的體重有一定的促進作用,在養殖期28和56d時均提高了特定生長率。Carnevali等使用德氏乳桿菌(Lactobacillus delbrueckii)投喂歐洲鱸魚(Dicentrarchus labrax),經25和59 d養殖后,發現其增重率分別比對照組提高了28%和81%。Lee等用戊糖乳桿菌(Lactobacillus pentosus)飼喂日本鰻鱺(Anguilla japonica),5周后發現在特定生長率、飼料轉化率及存活率方面均顯著優于對照組。
Illumina高通量測序技術測序深度大,對菌群多樣性的反應準確、全面,在魚類腸道菌群研究中獲得了廣泛應用。李建柱等采用高通量測序技術分析了養殖池塘鰱魚、鳙魚、鯽魚、草魚的腸道菌群組成,OTU數最低298個,最高412個,Shannon指數介于2. 21 ~ 3. 09。黃麗麗等在新疆額爾齊斯河流域的3種野生冷水魚(哲羅魚、細鱗鮭及黑斑狗魚)的6個樣品中共得到了58328條有效序列,OTU 數共242個。本研究中,6個樣本共獲得了有效序列數612446條,其中試驗組(58909條)有效序列數多于對照組(43164條),對照組OTU數777個,試驗組OTU數393個,且物種多樣性和豐富度方面對照組遠大于試驗組,說明益生菌植物乳桿菌降低了養殖細鱗鮭腸道菌群多樣性,使其菌群種類向簡單化發展。
魚類腸道菌群組成受宿主種類、發育時期、環境和飼料影響而有所差異。對新疆額爾齊斯河流域野生細鱗鮭腸道菌群組成的研究發現,變形菌門是細鱗鮭腸道菌群中的優勢菌門,屬水平上以嗜冷桿菌屬(Psychrobacter)、不動桿菌屬(Acinetobacter)、梭菌屬(Clostridium)等的比例較高。本研究發現,養殖細鱗鮭腸道微生物種類豐富,優勢菌門也是變形菌門,此外,厚壁菌門及藍細菌門的豐度也很高;在屬水平上與野生細鱗鮭差別較大,以勞爾氏菌屬、短螺旋體屬、普氏菌屬等的豐度較高。Lyons等同樣使用高通量測序技術研究了虹鱒的腸道菌群組成,發現γ-變形菌門占優勢,其中腸桿菌科(Enterobacteriaceae)的耶爾森氏菌屬(Yersinia)、沙雷氏菌屬(Serratia)、哈夫尼菌屬(Hafnia)和肥大桿菌屬(Obesumbacterium)等優勢明顯。總結來說,變形菌門是冷水魚腸道菌群中常見的優勢菌門,而在屬水平上隨著種類、養殖環境的變化差異更大。
本研究表明,飼料中添加植物乳桿菌使細鱗鮭腸道菌群中益生菌的豐度增加,其中乳桿菌屬的豐度由對照組的2. 89%提高到了試驗組的58.94%,增加了近20倍。此外,微小桿菌屬、腸球菌屬也占有很高的比例,它們均屬厚壁菌門的產乳酸菌。這些菌屬所占比例的增加使得試驗組腸道菌群中厚壁菌門的豐度達到了98%以上。微小桿菌屬能夠利用糖類發酵產酸,主要產乳酸、乙酸和甲酸,該屬很多種類被開發為益生菌,用于環境改良。腸球菌屬也是乳酸菌家族的重要成員,來自該屬的許多乳酸菌用于食品發酵及維持動物腸道健康等,特別是糞腸球菌,是該屬中最具代表性的益生菌,該菌不但可以產生乳酸,還可以分泌細菌素,抑制有害菌群的發展。而乳酸菌作為益生菌也被廣泛用于調控動物腸道菌群,增強宿主免疫力,抑制有害菌群,改善動物營養吸收、生長、發育與繁殖等。類似的研究結果也在鯽魚、羅非魚及虹鱒等魚類的腸道菌群研究中得到證實,表明植物乳桿菌對魚類腸道乳酸菌數量的提高具有顯著的效果。
物種豐富度是指群落中物種數目的多少,本試驗結果表明植物乳桿菌使細鱗鮭腸道菌群物種數目變少,在OTU水平上顯示49.42%的OTU由于植物乳桿菌的添加而從腸道菌群中消失,表明植物乳桿菌抑制了許多腸道菌群的生長,降低了細鱗鮭腸道菌群的多樣性。而這些消失的菌群很多是腸道內有害的革蘭氏陽性菌,如葡萄球菌屬、短螺旋體屬、桿菌屬、梭菌科、芽孢桿菌屬、副伯克氏菌屬、鏈球菌屬及類諾卡氏菌屬等。植物乳桿菌對藍細菌門的抑制作用也很顯著,其豐度從對照組的23.3%降低到了試驗組的<1%。藍細菌是一類廣泛存在于環境中的古老菌群,經常在動物腸道內檢測到。藍細菌并非魚類腸道固有微生物,而是來自餌料攜帶或水環境。對鯽魚的研究也發現,益生菌在增加乳酸菌豐度的同時,顯著降低了另外一些細菌的豐度,如好氧菌及產氣莢膜梭菌(Clostridium perfringens)。
本試驗通過在飼料中添加植物乳桿菌研究益生菌對細鱗鮭腸道菌群多樣性的影響,揭示了養殖模式下細鱗鮭腸道菌群的組成及其益生菌調控效應,為今后在魚類腸道微生物菌群調控技術方面以及在腸道微生物層面上研究冷水魚營養與生長、免疫與疾病等提供參考。
4. 結論
① 飼料中添加植物乳桿菌可以顯著提高細鱗鮭的特定生長率。
② 養殖細鱗鮭腸道菌群在門水平上以變形菌門、厚壁菌門和藍細菌門為主;在屬水平上分布較均勻,勞爾氏菌屬、短螺旋體屬、普氏菌屬的豐度較高但未形成優勢菌屬,菌屬種類繁多且豐度都較低。
③ 飼料中添加植物乳桿菌顯著改變了細鱗鮭腸道菌群組成,在門水平上厚壁菌門占絕對優勢,在屬水平上乳桿菌屬占優勢,未命名_藍細菌門豐度明顯下降。
④ 綜合認為,飼料中添加植物乳桿菌可使細鱗鮭腸道菌群物種多樣性和豐富度降低,益生菌豐度增加,并可促進細鱗魚生長。

相關鏈接:酶+菌融合預消化技術典型代表產品——養豬專用復合益生菌——規模養豬低成本生態健康養殖更好更專業復合益生微生物制劑產品,可以高溫制粒、直接加入飼料中、飲水中添加
【視頻】原聲不使用養豬專用復合益生菌與使用豬場的區別
相關鏈接——
①.99多功能飼料發酵劑——高濃度乳酸菌為主的固態飼料發酵劑,更輕易成功、效果更好的生物飼料發酵劑,簡單好用的中草藥發酵劑
②.99多功能飼料發酵劑,酶菌結合飼料發酵劑中的佼佼者,幾項數據對比讓你信服
③.【視頻】部分發酵飼料養豬雞鴨帶給你無臭味健康無抗養殖效果
⑤.御瘟湯——防控非洲豬瘟增加自制發酵中草藥體內外運用的原生中草藥配方
⑥.動物促生長增肥原生中草藥組方——效果直觀可見,生長速度提高顯著,降低料耗提前出欄
⑦.“土味十足”原生中草藥配方——效果顯著的動物肉蛋品質改良中草藥配方,比放養更土味十足
10.豬場復產成功案例,防控非洲豬瘟運用自制發酵中草藥更易成功,不需大設施投入成本低廉
12.2020年多年生禾本科高產牧草品種推薦,亞熱帶與大棚內可四季產出,提供專業種植、加工、利用、形成生態循環一條龍服務
13.養殖場廢水(污水)最簡單的快速處理技術,達標農灌水或者變成無臭味不燒苗的液態有機肥技術
14.新建豬場用哪種模式好?新型水泡糞技術模式節約30%以上建設成本與減少70%以上糞污處理環保建設
15.豬場復養如何才能成功?推薦自制發酵中草藥組合拳模式!數百成功案例歡迎驗證
16.豬場發現疑似感染非洲豬瘟后如何快速控制下來(20余天達到滿意效果,有大量成功案例)
17.養殖場托管找廣西助農公司,無專業技術員也能夠高效益生產,總有一種模式適合你
- 上一篇:豬拉稀腹瀉治療好方法 [2020-11-02]
- 下一篇:豬支原體肺炎,聯合用藥效果遠比單一用藥好 [2020-11-02]







